آنتی بادی ها که ایمونوگلوبولین ها (Ig) نیز نامیده می شوند، گلیکوپروتئین هایی هستند که به طور خاص به آنتی ژن ها متصل می شوند.
آماده سازی آنتی بادی معمولی با ایمن سازی حیوانات و جمع آوری آنتی سرم تولید می شود.بنابراین، آنتی سرم معمولاً حاوی آنتی بادی هایی علیه سایر آنتی ژن های نامرتبط و سایر اجزای پروتئینی در سرم است.مولکول های آنتی ژن عمومی عمدتا حاوی چندین اپی توپ مختلف هستند، بنابراین آنتی بادی های معمولی نیز مخلوطی از آنتی بادی ها در برابر چندین اپی توپ مختلف هستند.حتی آنتیبادیهای معمولی سرم که علیه همان اپی توپ قرار میگیرند، هنوز از آنتیبادیهای ناهمگن تولید شده توسط کلونهای مختلف سلول B تشکیل شدهاند.بنابراین، آنتی بادی های معمولی سرم را آنتی بادی های پلی کلونال یا به اختصار آنتی بادی های پلی کلونال نیز می نامند.
آنتی بادی مونوکلونال (آنتی بادی مونوکلونال) یک آنتی بادی بسیار یکنواخت است که توسط یک کلون سلول B تولید می شود و فقط علیه یک اپی توپ خاص هدایت می شود.معمولاً با فناوری هیبریدوم تهیه می شود - فناوری آنتی بادی هیبریدوما مبتنی بر فناوری همجوشی سلولی است که سلول های B را با توانایی ترشح آنتی بادی های خاص و سلول های میلوما با ظرفیت رشد نامحدود در هیبریدوم های سلول B ترکیب می کند.این سلول هیبریدوما ویژگی های یک سلول والد را دارد.این می تواند به طور نامحدود و جاودانه در شرایط آزمایشگاهی مانند سلول های میلوما تکثیر شود و می تواند آنتی بادی های خاصی مانند لنفوسیت های طحال را سنتز و ترشح کند.از طریق شبیه سازی، می توان یک خط مونوکلونال مشتق از یک سلول هیبریدوما، یعنی یک رده سلولی هیبریدوم به دست آورد.آنتیبادیهایی که تولید میکند، آنتیبادیهای بسیار همگن علیه همان عامل آنتی ژنیک، یعنی آنتیبادیهای مونوکلونال هستند.
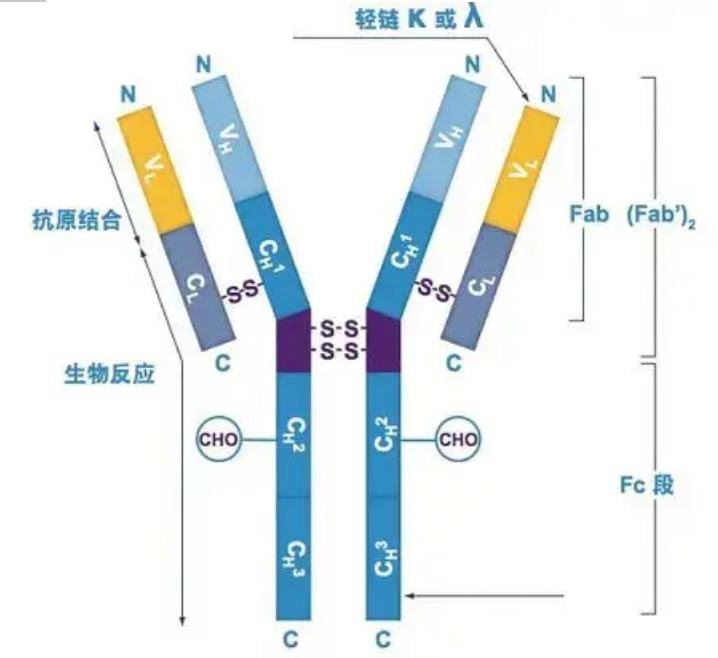
آنتی بادی ها به صورت یک یا چند مونومر Y شکل (یعنی آنتی بادی های مونوکلونال یا آنتی بادی های پلی کلونال) وجود دارند.هر مونومر Y شکل از 4 زنجیره پلی پپتیدی شامل دو زنجیره سنگین یکسان و دو زنجیره سبک یکسان تشکیل شده است.زنجیره سبک و زنجیره سنگین با توجه به وزن مولکولی نامگذاری می شوند.بالای ساختار Y شکل ناحیه متغیر است که محل اتصال آنتی ژن است.(گزیده ای از مفهوم آنتی بادی بیو مونوکلونال Detai)
ساختار آنتی بادی
 زنجیر سنگین
زنجیر سنگین
پنج نوع زنجیره سنگین Ig پستانداران وجود دارد که با حروف یونانی α، δ، ε، γ و μ نامگذاری شدهاند.آنتی بادی های مربوطه IgA، IgD، IgE، IgG و IgM نامیده می شوند.زنجیره های سنگین مختلف از نظر اندازه و ترکیب متفاوت هستند.α و γ حاوی تقریباً 450 اسید آمینه، در حالی که μ و ε تقریباً حاوی 550 اسید آمینه هستند.
هر زنجیره سنگین دارای دو ناحیه است: ناحیه ثابت و ناحیه متغیر.همه آنتی بادی های یک نوع دارای ناحیه ثابت یکسانی هستند، اما بین آنتی بادی های انواع مختلف تفاوت هایی وجود دارد.نواحی ثابت زنجیرههای سنگین γ، α و δ از سه حوزه Ig پشت سر هم تشکیل شدهاند که یک ناحیه لولا برای افزایش انعطافپذیری آن وجود دارد.مناطق ثابت زنجیره های سنگین μ و ε از 4 حوزه Ig تشکیل شده است.منطقه متغیر زنجیره سنگین آنتی بادی تولید شده توسط سلول های B مختلف متفاوت است، اما منطقه متغیر آنتی بادی تولید شده توسط همان سلول B یا کلون سلولی یکسان است و منطقه متغیر هر زنجیره سنگین حدود 110 اسید آمینه طول دارد.، و یک دامنه Ig تشکیل دهید.
زنجیر سبک
تنها دو نوع زنجیره سبک در پستانداران وجود دارد: نوع لامبدا و نوع کاپا.هر زنجیره سبک دارای دو حوزه مرتبط است: یک منطقه ثابت و یک منطقه متغیر.طول زنجیره سبک حدود 211 تا 217 اسید آمینه است.دو زنجیره سبک موجود در هر آنتی بادی همیشه یکسان هستند.برای پستانداران، زنجیره سبک در هر آنتی بادی فقط یک نوع دارد: کاپا یا لامبدا.در برخی از مهره داران تحتانی مانند ماهی های غضروفی (ماهی های غضروفی) و ماهیان استخوانی، انواع دیگری از زنجیره های سبک مانند نوع یوتا (یوتا) نیز یافت می شود.
بخش های Fab و Fc
بخش Fc را می توان مستقیماً با آنزیم ها یا رنگ های فلورسنت برای برچسب زدن آنتی بادی ها ترکیب کرد.این قسمتی است که در آن آنتی بادی در طی فرآیند الایزا روی صفحه می پیچد و همچنین بخشی است که در آن آنتی بادی دوم در رسوب ایمنی، بلات و ایمونوهیستوشیمی شناسایی و متصل می شود.آنتی بادی ها را می توان به دو بخش F(ab) و یک بخش Fc توسط آنزیم های پروتئولیتیک مانند پاپائین هیدرولیز کرد، یا می توان آنها را از ناحیه لولا توسط پپسین شکست و به یک بخش F(ab)2 و یک بخش Fc هیدرولیز کرد.قطعات آنتی بادی IgG گاهی اوقات بسیار مفید هستند.به دلیل فقدان بخش Fc، بخش F(ab) با آنتی ژن رسوب نمی کند و در مطالعات in vivo توسط سلول های ایمنی گرفته نمی شود.به دلیل کوچک بودن قطعات مولکولی و عدم عملکرد اتصال متقابل (به دلیل عدم وجود قطعه Fc)، بخش Fab معمولاً برای برچسب گذاری رادیویی در مطالعات عملکردی استفاده می شود و بخش Fc عمدتاً به عنوان یک عامل مسدود کننده در رنگ آمیزی هیستوشیمیایی استفاده می شود.
مناطق متغیر و ثابت
ناحیه متغیر (منطقه V) در 1/5 یا 1/4 (حاوی حدود 118 باقیمانده اسید آمینه) زنجیره H در نزدیکی انتهای N و 1/2 (حاوی حدود 108-111 باقی مانده اسید آمینه) در نزدیکی انتهای N زنجیره L قرار دارد.هر ناحیه V دارای یک حلقه پپتیدی است که توسط پیوندهای دی سولفیدی درون زنجیره ای تشکیل شده است و هر حلقه پپتیدی تقریباً حاوی 67 تا 75 باقیمانده اسید آمینه است.ترکیب و آرایش اسیدهای آمینه در ناحیه V ویژگی اتصال آنتی ژن آنتی بادی را تعیین می کند.با توجه به انواع و توالی اسیدهای آمینه در حال تغییر در ناحیه V، انواع زیادی از آنتی بادی ها با ویژگی های آنتی ژن اتصال متفاوت می توانند تشکیل شوند.نواحی V زنجیره L و زنجیره H به ترتیب VL و VH نامیده می شوند.در VL و VH، ترکیب اسید آمینه و توالی برخی از مناطق محلی دارای درجه تنوع بالاتری است.به این نواحی، مناطق هیپرمتغیر (HVR) می گویند.ترکیب اسید آمینه و آرایش قطعات غیر HVR در ناحیه V نسبتا محافظه کارانه است که به آن منطقه چارچوب می گویند.سه ناحیه بیش متغیر در VL وجود دارد که معمولاً به ترتیب در بقایای اسید آمینه 24 تا 34 و 89 تا 97 قرار دارند.سه HVR VL و VH به ترتیب HVR1، HVR2 و HVR3 نامیده می شوند.تحقیق و تجزیه و تحلیل پراش کریستال اشعه ایکس ثابت کرد که ناحیه بیش متغیر در واقع محلی است که آنتی ژن آنتی بادی در آن متصل می شود، بنابراین به آن منطقه تعیین کننده مکمل (CDR) می گویند.HVR1، HVR2 و HVR3 VL و VH را می توان به ترتیب CDR1، CDR2 و CDR3 نامید.به طور کلی، CDR3 دارای درجه بالاتری از تغییرپذیری است.ناحیه بیشمتغیر همچنین محل اصلی است که تعیینکنندههای ایدیوتیپی مولکولهای Ig وجود دارد.در بیشتر موارد، زنجیره H نقش مهم تری در اتصال به آنتی ژن ایفا می کند.
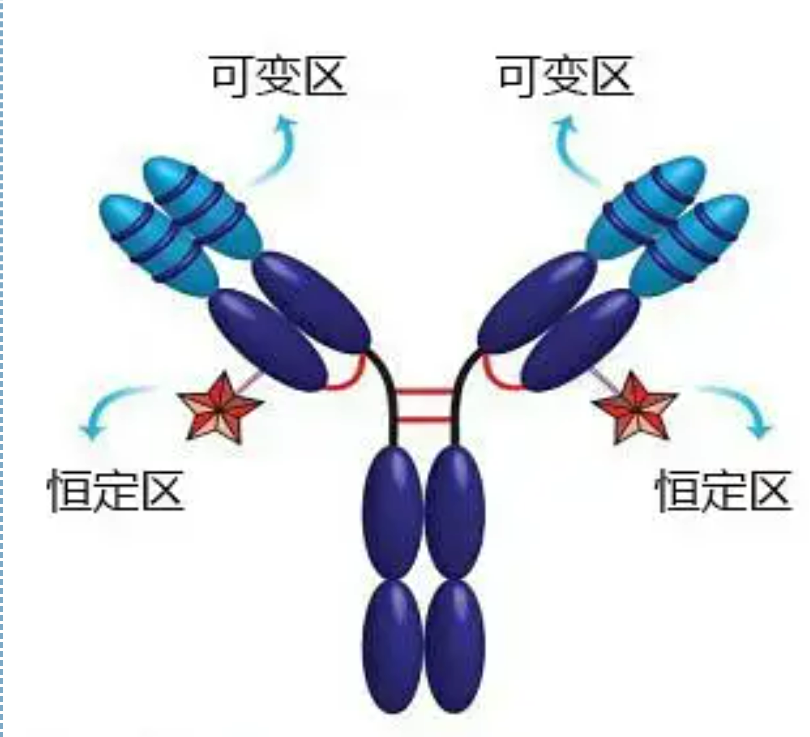 ناحیه ثابت (منطقه C)در 3/4 یا 4/5 (تقریباً از اسید آمینه 119 تا پایانه C) زنجیره H در نزدیکی انتهای C و 1/2 (حاوی حدود 105 باقی مانده اسید آمینه) در نزدیکی انتهای C زنجیره L قرار دارد.هر ناحیه عملکردی زنجیره H حاوی حدود 110 باقیمانده اسید آمینه است و حاوی یک حلقه پپتیدی متشکل از 50-60 باقی مانده اسید آمینه است که توسط پیوندهای دی سولفیدی به هم متصل شده اند.ترکیب اسید آمینه و آرایش این ناحیه در زنجیره L ایزوتیپ Ig حیوانی و زنجیره H همان نوع نسبتاً ثابت است.همان، فقط می تواند به طور خاص به آنتی ژن مربوطه متصل شود، اما ساختار منطقه C آن یکسان است، یعنی آنتی ژنی یکسانی دارد.آنتی بادی ثانویه ضد IgG اسب (یا آنتی بادی) را می توان با دو آنتی بادی ترکیب کرد (IgG) در برابر اگزوتوکسین های مختلف رخ می دهد.این یک پایه مهم برای تهیه آنتی بادی های ثانویه و استفاده از فلورسین، ایزوتوپ ها، آنزیم ها و سایر آنتی بادی های نشاندار شده است.
ناحیه ثابت (منطقه C)در 3/4 یا 4/5 (تقریباً از اسید آمینه 119 تا پایانه C) زنجیره H در نزدیکی انتهای C و 1/2 (حاوی حدود 105 باقی مانده اسید آمینه) در نزدیکی انتهای C زنجیره L قرار دارد.هر ناحیه عملکردی زنجیره H حاوی حدود 110 باقیمانده اسید آمینه است و حاوی یک حلقه پپتیدی متشکل از 50-60 باقی مانده اسید آمینه است که توسط پیوندهای دی سولفیدی به هم متصل شده اند.ترکیب اسید آمینه و آرایش این ناحیه در زنجیره L ایزوتیپ Ig حیوانی و زنجیره H همان نوع نسبتاً ثابت است.همان، فقط می تواند به طور خاص به آنتی ژن مربوطه متصل شود، اما ساختار منطقه C آن یکسان است، یعنی آنتی ژنی یکسانی دارد.آنتی بادی ثانویه ضد IgG اسب (یا آنتی بادی) را می توان با دو آنتی بادی ترکیب کرد (IgG) در برابر اگزوتوکسین های مختلف رخ می دهد.این یک پایه مهم برای تهیه آنتی بادی های ثانویه و استفاده از فلورسین، ایزوتوپ ها، آنزیم ها و سایر آنتی بادی های نشاندار شده است.
محصولات مرتبط:
کیت Cell Direct RT-qPCR
زمان ارسال: سپتامبر 30-2021








